大麻草を原料とした医薬品の使用が国会で承認されました(2023/12/6)
大麻草を原料とした医薬品の使用が国会で承認されました。
これまで日本国内では大麻取締法で使用が禁じられていましたが、今回、国会で承認されたことにより、難治性のてんかん治療を目的とした医療用医薬品としての使用が可能となります。
法改正により「大麻草を原料とした医薬品の使用」および「大麻草の栽培を医薬品などの原料を採取する目的で認める」としています。
一方で、若者などの乱用を防ぐ目的で「麻薬及び向精神薬取締法」で取り締まる「麻薬」に位置付けて「所持・譲渡・使用」の禁止が盛り込まれました。

大麻
医療用大麻「エピディオレックス」の治験が日本国内で実施見通し(2022/4/23)
小児の希少疾患「トラベ症候群」」「レノックス・ガストー症候群」の治療薬として海外で使用されているものの、大麻由来成分含有製剤であるため日本国内での取り扱いが禁止されている「エピディオレックス」に関して、日本国内にて医薬品としての臨床試験が開始される見通しであることが報道されました。
エピディオレックスは大麻由来のカンナビジオールを主成分としており、難治性のてんかん治療薬として米国で2018年、欧州で2019年に承認されているものの、日本国内で取り扱いが禁止されている成分です。
難治性てんかん患者数:日本国内にはおよそ7000人患者がいると推定されています。
エピディオレックスの使用に関しては、大麻取締法などの規制を変更する必要があるため、厚生労働省は2022年秋の法改正を目指すとしています。
以下に、エピディオレックスの治験開始に至るまでの、これまでの経緯を記します。
医療用大麻の実用化について(2021/6/2)
2021年に入り、日本国内でも医療用大麻の実用化に向けた議論が進展しています。
このままのペースで議論が進めば、2022年以降に法整備が行われ、日本国内でも治験などの臨床試験において医療用麻薬の使用が認めれるものと個人的には推測しています。
2021年に入り、厚生労働省で話し合われている“医療用大麻”とは、乳幼児や小児期に発症する「難治性のてんかん(遺伝性疾患)治療薬の実用へ向けて」という案件がメインテーマだと私は考えています。
米国では2021年に入り、嗜好品として「嗜好用大麻」が多くの州で合法化されていますが、日本国内における「医療用大麻の実用化」と「米国における嗜好用大麻の解禁」は意味合いが大きく異なりますのでご留意ください。
注)「米国における嗜好用麻薬の解禁」は、コロナショックによる経済打撃の緩和策として多額の公的資金(国のお金)が給付金として国民や市場に流れました。その公的資金の回収策の一環として嗜好用大麻を解禁し、嗜好用大麻販売における税収を見込んだものと個人的には考えています。(日本におけるタバコ税のようなものです)
話を日本国内の「医療用大麻の実用化」へ話を戻します。
2018年6月29日に米国にて大麻由来の成分で作られた医薬品「カンナビジオール経口液剤」が医薬品として認可されました。適応症は小児・乳幼児時に発症する「難治性てんかんであるレノックスガストー症候群およびドラベ症候群です。
カンナビジオール経口液剤はドラベ症候群に対する唯一の治療薬です。
(トラベ症候群に伴う発作の治療薬として商品名Fintepla(fenfluramine)が2020年6月に承認されています)
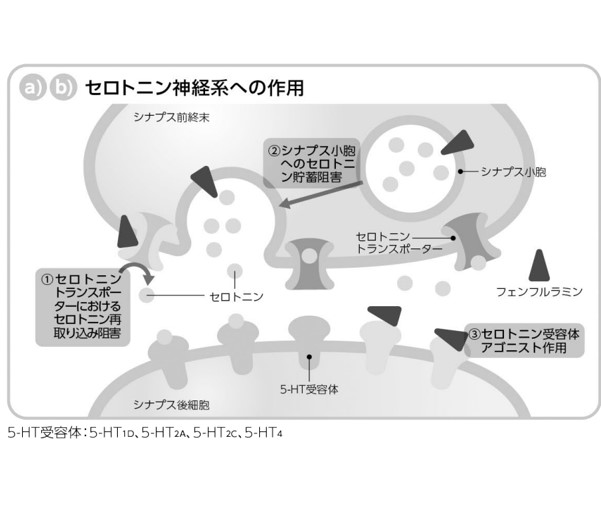
2021年6月時点において、日本の「大麻取締法第4条第1項」において、大麻から製造した医薬品の使用は禁止さてれいます。唯一、大麻研究者は厚生労働大臣の許可を受けた場合のみ「大麻」を輸入することができると明記されていますが、実質的には不可能なレベルです。
米国にてドラベ症候群に対する治療薬が開発されたにも関わらず、日本国内での販売はもとより、治験(臨床試験)すらも難しい現在の「大麻取締法」はいかがなものか?という昨今の実情を踏まえて、「大麻規制のありかた」についての国内ルールを見直してみようという感じが今の厚生労働省の流れです。
具体的な見直し案としては「大麻がダメ」というこれまでの考えから「大麻に含まれているTHCという有害物質がダメ」というルールに変えましょうという感じです。
注)THCとはテトラヒドロカンナビノールという一般名称で、いわゆる高揚感・多幸感などの精神作用が強い作用を有する成分です。

厚生労働省における「麻薬規制のありかた」についての議論は今後とも続くわけですが、「麻薬はダメ」というこれまでの知見は古いですよ、2020年にWHOが「麻薬単一条約において医療上の有用性が認められる」という見解をしめしており、「大麻から製造された医薬品がG7諸国において難治性てんかん治療薬として認可されている」実情を踏まえて日本国内の「麻薬及び向精神薬取締法」をちょっとだけ見直しましょうといった感じの内容であると私は認識しております。
不動品の麻薬を他薬局へ小分けできるルール(令和4年4月1日スタート)
麻薬及び向精神薬取締法施行規則の一部が2021年7月5日より改正され、同一都道府県の区域内において、「譲受・譲渡した日から90日を経過した麻薬(不動品)」を近隣の麻薬小売業者間で譲渡・譲受することができる旨が追記されました。
令和4年(2022年)4月1日からスタートします。以下に詳細を記します。
2022年4月1日から麻薬の小分け販売OK(同一都道府県内)
麻薬小分けをOKにした改正理由
疼痛等の緩和を目的とする在宅医療の推進のため、麻薬が適切かつ円滑に患者に対し提供される必要性が高まっている中、麻薬小売業者が自らの麻薬の在庫不足により、急な麻薬処方せんに対応できない場合に限り、当該不足分を近隣の麻薬小売業者間で譲渡・譲受することを可能としてきたところである。 今回、薬局において医療用麻薬が適切かつ円滑に患者に提供されることを目的として、新たに麻薬小売業者が麻薬卸売業者から譲り受けた麻薬について、一定の条件の下、90 日以上譲渡譲受がない場合において、近隣の麻薬小売業者間で譲渡・譲受することを可能とした。
麻薬小売業者間譲渡許可の申請について
2以上の麻薬小売業者は、以下に掲げるすべての要件を満たす場合に限り、共同して、麻薬小売業者間譲渡許可を申請することができること。
・ いずれの麻薬小売業者も、次に掲げる場合に限り、麻薬を譲り渡そうとする者であること。
イ :共同して申請する他の麻薬小売業者が、その在庫量の不足のため麻薬処方せんにより調剤することができない場合において、当該不足分を補足する必要があると認めるとき
ロ: 麻薬卸売業者から譲り受けた麻薬であって、その譲受けの日から 90日を経過したものを保管しているとき、又は麻薬卸売業者から譲り受けた麻薬について、その一部を法第 24 条第 11 項若しくは第 12 項の規定に基づき譲り渡した場合において、その残部であって、その譲渡しの日から 90 日を経過したものを保管しているとき
・ いずれの麻薬小売業者も、当該免許に係る麻薬業務所の所在地が同一の都道府県の区域内にあることなお、麻薬小売業者間譲渡許可後、イについて在庫量の不足以上の譲渡を行うこと、ロについて麻薬卸売業者から譲り受けた麻薬以外の譲渡を行うこと、譲受けの日から 90 日を経過していない麻薬の譲渡を行うこと等、上記に反する譲渡を行った場合には、法第 64 条の2又は第 66条に該当しうることに留意すること。
「2以上の麻薬小売業者が共同でこの麻薬小売業者間譲渡許可を申請する」というルールですので、90日以上不動となった麻薬を保管しているチェーン薬局(同一都道府県)などが共同で申請する流れが想定されます。
90日間という期間が設定された理由としては、「1つの薬局が麻薬を大量に買い付けて保管し、同一麻薬小売業者間譲受許可を取得した薬局に日常的に譲渡を行うことを防ぐため」、「麻薬は保険上の処方日数制限が30日と定められており、不動在庫となる期間を含めて90日の期間を設定した」と記されています。

コメント